Wie beim klassischen griechischen Drama gibt es Geschichten, die in mehreren Akten verlaufen. Die nachfolgende Geschichte verläuft bislang in drei Akten und hoffentlich ist sie nun abgeschlossen.
Hier der erste Akt:
Anfang Dezember 2025 veröffentlichte Abbott eine dringende Sicherheitswarnung für zwei seiner CGM-Systeme: FreeStyle Libre 3 und Libre 3 Plus. Hintergrund ist ein Produktionsfehler, durch den einige Sensoren fälschlich zu niedrige Glucosewerte anzeigt haben. Solche Fehlanzeigen bergen ein erhebliches Risiko: Betroffene könnten Insulindosen auslassen oder verzögern und übermäßig Kohlenhydrate zuführen – mit potenziell gefährlichen Folgen.
Nach Angaben des Herstellers gingen weltweit 736 Berichte über schwerwiegende unerwünschte Ereignisse ein, darunter sieben Todesfälle. In den USA wurden 57 schwerwiegende Ereignisse gemeldet, jedoch keine Todesfälle.
Der Produktionsfehler betrifft schätzungsweise rund drei Millionen Sensoren. Laut Abbott ist etwa die Hälfte davon bereits verwendet oder abgelaufen. Das Unternehmen erklärt, die Ursache inzwischen behoben zu haben; Lieferengpässe seien nicht zu erwarten, da andere Produktionslinien regulär weiterlaufen. Betroffen sind ausschließlich ausgewählte Chargen folgender Modelle:
- FreeStyle Libre 3
Modellnummern: 72081-01, 72090-01
Gerätekennungen: 00357599818005, 00357599819002 - FreeStyle Libre 3 Plus
Modellnummern: 78768-01, 7869-01
Gerätekennungen: 00357599844011, 00357599843014
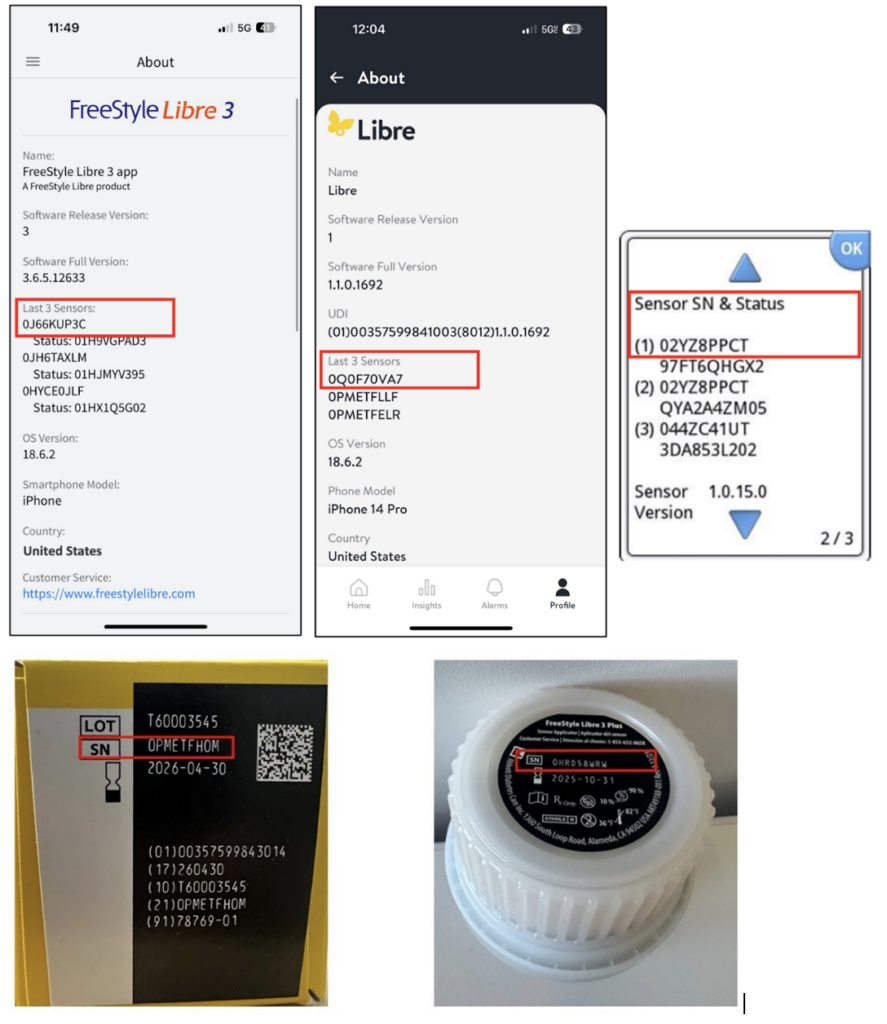
Nutzer wurden dringend aufgefordert zu prüfen, ob ihre Sensoren zu den betroffenen Chargen gehören. Abbott stellt kostenlosen Ersatz bereit. Die Seriennummer befindet sich auf dem Applikator-Etikett, auf der Verpackungsunterseite sowie im Lesegerät bzw. in der App. Eine Online-Prüfung ist über das offizielle Portal möglich.
Wichtig: Andere Produkte des Libre-Portfolios, darunter Libre 14 Tage, Libre 2, Libre 2 Plus, Libre Pro, Lesegeräte und mobile Apps, sind nach aktuellem Stand nicht betroffen. Die FDA veröffentlicht zusätzlich eine vollständige Chargenliste für Produkte innerhalb und außerhalb der USA.
Der zweite Akt – FDA greift ein: Was als technische Sicherheitsmeldung begann, hat sich zu einem regulatorischen Großereignis entwickelt. Dieser Fall zeigt, wie eng Medizintechnik, Qualitätskontrolle und Patientensicherheit miteinander verflochten sind – und wie schnell aus einem Produktionsproblem ein Thema für die höchste Aufsichtsebene werden kann.
Anfang Februar 2026 nämlich erhielt Abbott ein formelles Warnschreiben der US-Zulassungsbehörde FDA. Solche Schreiben gehören zu den schärferen regulatorischen Instrumenten der Behörde und werden eingesetzt, wenn erhebliche Verstöße gegen Qualitäts- und Sicherheitsvorschriften festgestellt werden.
Auslöser war eine FDA-Inspektion des Diabetes-Standorts in Alameda, Kalifornien, im Zeitraum vom 14. bis 23. Oktober 2025. Nach Darstellung der Behörde wurden fertige CGM-Systeme in den Verkehr gebracht, ohne dass ihre Messgenauigkeit nach vollständiger Montage, Sterilisation und Programmierung ausreichend geprüft worden war.
Die FDA identifizierte vier zentrale Verstöße, insbesondere im Zusammenhang mit:
- der Genauigkeitsprüfung fertiger Geräte
- unzureichenden statistischen Prüfverfahren
- fehlenden validen Akzeptanzkriterien
- mangelhaften Stichprobenplänen
Eine erste Stellungnahme des Unternehmens aus dem Jahr 2025 bewertete die Behörde als „unzureichend“. Abbott wurde aufgefordert, innerhalb von 15 Werktagen – bis zum 13. Februar 2026 – konkrete Korrekturmaßnahmen vorzulegen und darzulegen, wie zukünftige Verstöße verhindert werden sollen.
Abbott erklärte daraufhin schriftlich, bereits mit umfassenden Korrekturmaßnahmen begonnen zu haben und die FDA fortlaufend über den Fortschritt zu informieren.
Nun zum dritten Akt – Rückruf der höchsten Kategorie: Am 5. Februar 2026 folgte der bislang drastischste Schritt: Die FDA stufte bestimmte betroffene Sensoren in einen Class-I-Rückruf ein und damit die höchste Rückrufkategorie. Diese Klassifizierung bedeutet, dass eine begründete Wahrscheinlichkeit besteht, dass die weitere Verwendung der Produkte zu schweren Verletzungen oder zum Tod führen kann.
Bis zum 7. Januar 2026 lagen Abbott zufolge bereits 860 Meldungen über schwerwiegende Vorfälle sowie sieben Todesfälle im Zusammenhang mit den Sensoren vor. Abbott empfiehlt ihren Anwendern nun dringend:
- zu prüfen, ob ihre Sensoren betroffen sind
- die Nutzung betroffener Sensoren sofort einzustellen
- diese ordnungsgemäß zu entsorgen
Ersatzsensoren werden kostenfrei bereitgestellt. Zusätzlich rät das Unternehmen, bei unplausiblen CGM-Werten zur Absicherung auf klassische Blutzuckermessungen zurückzugreifen.
Fazit: Produktionsprobleme bei Medizinprodukten sind zwar inakzeptabel und sollten durch funktionierende Qualitätskontrollen verhindert oder früh erkannt werden, in der Praxis treten sie dennoch auf, auch bei CGM-Systemen anderer Hersteller. Entscheidend ist daher, dass Unternehmen schnell, transparent und konsequent reagieren.
Es ist zu erwarten, dass Abbott die regulatorischen Anforderungen erfüllt und seine Prozesse stabilisiert. Der Vorfall dürfte jedoch über den Einzelfall hinauswirken: Die Qualitätsaufsicht bei CGM-Systemen wird künftig noch stärker in den Fokus rücken.
Wichtig zu sagen ist zudem, dass Abbott kein Einzelfall ist. Auch andere Hersteller wie Dexcom und Beta Bionics erhielten zuletzt FDA-Warnungen. Die Branche befindet sich offenbar in einer Phase regulatorischer Nachschärfung – und das ist letztlich ein notwendiger Schritt zur Stärkung von Sicherheit und Vertrauen.
Dieser Artikel erscheint als Teil des wöchentlichen Letters zu hochaktuellen Entwicklungen im Bereich Diabetes Technologie. Nutzen Sie das nebenstehende Formular um sich für den diatec weekly Newsletter anzumelden!
Mit freundlichen Grüßen
![]()

