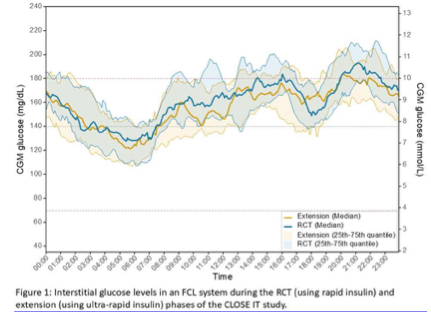
- Vergleich von schnell und ultraschnell wirksamem Insulin in einem Fully Closed Loop-System
Nanayakkara (SO 078-864) präsentierte in einer Postersession die Ergebnisse der CLOSE IT-Studie, in der ein Fully-Closed-Loop-System (FCL) getestet wurde, das ohne Mahlzeitenankündigungen auskommt. Grundlage war der Open-Source-Algorithmus „oref1“, der die Insulinzufuhr vollständig automatisiert. Ziel der Erweiterungsstudie war es, die Leistung von schnell wirksamem Insulin Aspart mit der von ultraschnell wirksamem Insulin Aspart + Niacinamid in einem FCL-System zu vergleichen. Die Untersuchung war einarmig und nach dem Vorher-Nachher-Prinzip angelegt. Sie war eingebettet in eine offene, parallele Nichtunterlegenheitsstudie mit insgesamt 73 erwachsenen Personen mit Typ-1-Diabetes (T1D), die ein AID-System mit Open-Source-Algorithmus nutzten.
Für die FCL-Erweiterung wurden 20 Teilnehmer ausgewählt (60 % Männer, medianes Alter 36 Jahre [IQR 29–52], T1D-Dauer 20 Jahre [11–25]). Sie verwendeten zunächst 12 Wochen lang das FCL-oref1-System mit schnell wirksamem Insulin und wechselten anschließend für 4 Wochen auf ultraschnell wirksames Insulin.
Hier die Ergebnisse: Der primäre Endpunkt war die Zeit im Zielbereich (TIR, 70–180 mg/dl [3,9–10,0 mmol/l]) während der letzten zwei Wochen jeder Behandlungsphase. Sekundäre Endpunkte waren ein mittlerer Glucosespiegel, Glucosevariabilität, Zeit im engen Zielbereich (TITR, 70–140 mg/dl [3,9–7,8 mmol/l]), Zeit unterhalb (TBR <70 mg/dl [<3,9 mmol/l]) und oberhalb des Zielbereichs (TAR >180 mg/dl [>10,0 mmol/l]).
Die TIR stieg von 65±10 % auf 68±10 %, was einem durchschnittlichen Anstieg um 3,0 % entspricht (95 %-KI −0,04 bis 6,0; p = 0,053). Der mittlere Glucosewert war in beiden Phasen vergleichbar (9±0,9 vs. 8,8±1,0 mmol/l; mittlere Veränderung −3,5 [−10 bis 3,0] mmol/l; p = 0,3). Auch die TBR (0,3±0,3 vs. 0,3±0,3 %; p = 0,8) und TAR (33±10 vs. 30±11 %; p = 0,079) blieben ähnlich. Die TITR erhöhte sich leicht von 43±9 % auf 47±11 % (mittlere Differenz 3,6 [−0,28 bis 7,4] %; p = 0,067). Weder beim Glucose-Management-Indikator (7,2±0,4 vs. 7,1±0,4 %; p = 0,3) noch beim Variationskoeffizienten (37,4±3,5 vs. 37,1±5,0 %; p = 0,7) zeigten sich signifikante Unterschiede. Es traten keine schweren Hypoglykämien oder Ketoazidosen (DKA) auf.
Fazit: Zwischen schnell und ultraschnell wirksamem Insulin Aspart zeigte sich in diesem vollständig automatisierten FCL-System kein signifikanter Unterschied in der Glucosekontrolle. Die Ergebnisse deuten darauf hin, dass die Wirksamkeit des Open-Source-Algorithmus „oref1“ im FCL-Betrieb weitgehend unabhängig von der Insulin-Kinetik ist – ein wichtiger Schritt auf dem Weg zu vollständig automatisierten AID-Systemen.
- Einfluss von ultraschnell wirksamem Insulin Lispro (URIL) auf die Glucosekontrolle bei versäumtem Mahlzeitenbolus unter FCL-Bedingungen
Das Schätzen des Kohlenhydratgehalts und das Abgeben von Insulinboli vor Mahlzeiten ist für viele Menschen mit T1D nach wie vor eine erhebliche Herausforderung. Wie ist der Einfluss von ultraschnell wirksamem Insulin Lispro (URIL) auf die Glucosekontrolle bei versäumtem Mahlzeitenbolus unter FCL-Bedingungen? Ultraschnelles Insulin Lispro (URIL) zeichnet sich im Vergleich zu Standard-Insulin Lispro (IL) durch einen schnelleren Wirkungseintritt, eine frühere maximale Insulinexposition und ein rascheres Abklingen der Wirkung aus. H. Thabit (SO 081-889) präsentierte die Ergebnisse einer klinisch-experimentellen Studie, die untersuchte, ob ein FCL mit URIL die Glucosekontrolle verbessert – insbesondere unter Bedingungen, die einen versäumten Mahlzeitenbolus simulieren.
Die Studie war offen, randomisiert und als Crossover-Design angelegt. Teilgenommen haben 18 Erwachsene mit Typ-1-Diabetes, die bereits eine Insulinpumpe verwendeten (12 Frauen, medianes Alter 33 Jahre [IQR 29–55], mittlerer HbA1c 58,3±8,8 mmol/mol).
Jede Person absolvierte zwei 8-stündige stationäre Sitzungen, bei denen die Glucosewerte mithilfe des CamAPS-Closed-Loop-Systems gesteuert wurden – einmal mit URIL, einmal mit IL, in zufälliger Reihenfolge. Um 11:00 Uhr vormittags erhielten die Teilnehmer jeweils eine standardisierte Mahlzeit, jedoch ohne Mahlzeitenbolus, um das Verhalten des Systems bei einem „vergessenen Bolus“ zu simulieren. Der primäre Endpunkt war der Anteil der TIR, gemessen mittels CGM. Daten von 17 Teilnehmenden (94 %) wurden in die Analyse einbezogen.
Hier die Ergebnisse: Die TIR war bei Verwendung von URIL numerisch höher als bei IL, jedoch nicht statistisch signifikant: URIL: 49,3 % (KI 41,3–57,3 %); IL: 39,9 % (30,2–49,7 %); p = 0,072.
Auch bei den Hyperglykämie-Werten zeigte sich ein günstiger, wenn auch nicht signifikanter Trend:
- Level 1 (>10 mmol/l): URIL 50,7 % vs. IL 59,5 % (p = 0,098)
- Level 2 (>13,9 mmol/l): URIL 18,7 % vs. IL 27,9 % (p = 0,136)
In den vier Stunden nach der Mahlzeit war der Trend ähnlich:
- TIR: URIL 23,4 % vs. IL 18,9 % (p = 0,356)
- Level 1 Hyperglykämie: URIL 76,6 % vs. IL 80,3 % (p = 0,491)
- Level 2 Hyperglykämie: URIL 33,4 % vs. IL 45,3 % (p = 0,224)
Die Zeit in Hypoglykämie (Level 1 und 2) war insgesamt gering und unterschied sich zwischen beiden Behandlungen nicht signifikant (p > 0,05).
Fazit: Ein versäumter Mahlzeitenbolus führte unter FCL-Bedingungen mit ultraschnell wirksamem Insulin Lispro (URIL) zu einem klinisch relevanten Trend: mehr Zeit im Zielbereich und weniger Hyperglykämien im Vergleich zu Standard-Insulin Lispro (IL) – ohne Zunahme von Hypoglykämien. Diese Ergebnisse unterstreichen das Potenzial schneller und ultraschneller Insuline, die Belastung durch manuelle Bolusgaben weiter zu verringern und FCL-Systeme künftig noch autonomer zu machen.
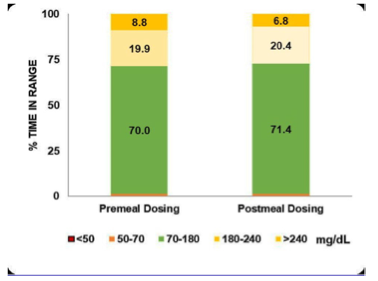
- Wirkung von Ultra Rapid Insulin Lispro (URIL) bei Gabe nach den Mahlzeiten in Kombination mit dem MiniMed 780G-System
Wie ist die Wirkung von URIL bei Gabe nach den Mahlzeiten in Kombination mit dem MiniMed 780G-System: Diese Frage beantwortete R. Eldor (SO 081-890) und stellte in einer Pilotstudie die Frage, ob URIL in Kombination mit den Autokorrekturmechanismen des AID-Systems eine Bolusgabe nach den Mahlzeiten erlaubt, ohne die Glucosekontrolle zu verschlechtern.
Die manuelle Bolusgabe vor den Mahlzeiten setzt voraus, dass die Nutzer die Kohlenhydratmenge ihrer Mahlzeiten korrekt schätzen – eine alltägliche, aber fehleranfällige Herausforderung. Tatsächlich verabreichen etwa 34 % der Menschen mit T1D ihre Mahlzeitenboli regelmäßig während oder nach dem Essen, was nachweislich mit schlechteren glykämischen Ergebnissen verbunden ist. URIL weist eine schnellere Absorptionskinetik auf als herkömmliches Insulin Lispro (IL) und könnte daher eine effektivere postprandiale (nachträgliche) Bolusgabe ermöglichen.
Studiendesign: In die Studie wurden 12 Erwachsene mit T1D eingeschlossen (7 Frauen = 56,3 %; Alter 40,9±16,3 Jahre; Diabetesdauer 15,5±11,4 Jahre; BMI 25,1 ± 6,0 kg/m²). Alle Teilnehmenden verwendeten das MiniMed 780G-System mit URIL bereits seit mindestens zwei Monaten(Durchschnitt 16,9±6,8 Monate). Der mittlere HbA1c lag bei 6,7±1,0 %.
Vor Studienbeginn wurden die Patienten routinemäßig angeleitet, Bolusgaben vor den Mahlzeiten durchzuführen. In der anschließenden vierwöchigen Interventionsphase sollten sie die Bolusgaben erst am Ende der Mahlzeitverabreichen. Die Nutzung von SmartGuard und CGM-Sensoren blieb in beiden Phasen hoch und stabil: SmartGuard: 90,1 % (vorher) vs. 93,9 % (während der Intervention) und Sensornutzung: 88,3 vs. 91,3 %.
Die Ergebnisse: Im Vergleich zwischen Vor-Mahlzeit-Bolus (Baseline) und Nach-Mahlzeit-Bolus mit URIL zeigten sich keine signifikanten Unterschiede in den zentralen Parametern der Glucosekontrolle:
| Parameter | Vor-Mahlzeit-Bolus | Nach-Mahlzeit-Bolus | p-Wert |
| TIR (70–180 mg/dl) | 70,0±11,9 % | 71,4±10,8 % | 0,48 |
| TINR (70–140 mg/dl) | 45,0±11,0 % | 45,7±11,3 % | 0,74 |
| GMI | 7,0±0,3 % | 7,0±0,4 % | 0,29 |
| Glucosevariabilität | 33,8±5,2 % | 32,7±4,7 % | 0,41 |
Eine leichte, aber signifikante Zunahme zeigte sich bei der gesamttäglichen Insulindosis (57,1±36,8 → 60,2±36,7 E; p = 0,03) sowie bei der Basalinsulinabgabe (23,5±19,0 → 26,5±20,6 E; p = 0,005).
Fazit: Die Gabe von URIL nach den Mahlzeiten führte zu einer vergleichbaren Glucosekontrolle wie die konventionelle Vor-Mahlzeit-Gabe mit herkömmlichem Lispro. Damit zeigt die Studie, dass URIL in Kombination mit modernen AID-Systemen eine flexiblere Insulintherapie ermöglichen kann – insbesondere für Nutzer, die Bolusgaben häufig verzögern. Langfristig könnten solche Ansätze dazu beitragen, die tägliche Therapielast zu verringern, ohne die glykämische Stabilität zu gefährden.
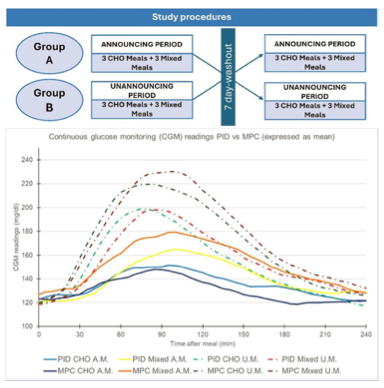
- Vergleich zweier AID-Algorithmen bei unangekündigten Mahlzeiten in pädiatrischer T1D-Kohorte
Nach wie vor sind unangekündigte Mahlzeiten für AID-Systeme eine große Herausforderung. Salvatore Scirè Calabrisotto von der Universität Catania, Italien (OP47-259) hat untersucht, wie zwei unterschiedliche Regelalgorithmen auf solche Situationen reagieren – der proportional-integral-derivative (PID)-Algorithmus in der MiniMed 780G und das modellprädiktive Kontrollsystem (MPC) in der Tandem t:slim X2.
Beide Systeme verfügen über automatische Korrekturfunktionen (Auto-Correction-Bolus bei MiniMed 780G bzw. AutoBolus bei Control-IQ/Control-IQ+), die darauf ausgelegt sind, rasche Glucoseschwankungen nach unangekündigten Mahlzeiten zu korrigieren. Frühere Studien hatten bereits gezeigt, dass diese Funktionen auch bei Personen, die häufig Mahlzeitenboli vergessen, zu stabilen glykämischen Ergebnissen führen können.
In die randomisierte Crossover-Studie wurden 20 Jugendliche mit T1D im Alter von 11 bis 18 Jahren eingeschlossen. Einschlusskriterien waren eine AID-Nutzung seit mindestens drei Monaten und eine Diabetesdauer von mindestens einem Jahr. Das Durchschnittsalter betrug 15 Jahre, 35 % waren weiblich, der mittlere HbA1c-Wert lag bei 6,9 %, der durchschnittliche TIR bei 76 %. Bewertet wurden u. a. die Glucoseänderungen nach 2 und 4 Stunden (ΔBG, gemessen per CGM), der Glucosespitzenwert und Zeit bis zum Erreichen der Spitze, die TIR, über (TAR) und unter (TBR) dem Zielbereich und die TiTR.
Die Teilnehmer erhielten zwei Arten von Frühstück: 1. Eine Kohlenhydratreiche Mahlzeit (Brot und Marmelade) und 2. Eine gemischte Mahlzeit mit zusätzlich 15 g Protein. Beide Mahlzeiten wurden unter angekündigten (A.M.) und unangekündigten Bedingungen (U.M.) eingenommen. Die Kinder wurden randomisiert in zwei Gruppen eingeteilt: Gruppe A mit einer zunächst angekündigten und danach unangekündigte Mahlzeiten (nach 7-tägiger Auswaschphase) sowie Gruppe B mit umgekehrter Reihenfolge.
Die Ergebnisse zeigten, dass unangekündigte Mahlzeiten im Vergleich zu angekündigten zu einem signifikant höheren Glucoseanstieg nach 2 Stunden führten, während sich die Werte nach 4 Stunden nicht mehr unterschieden: 2 h ΔBG (mg/dl): A.M. 72±45 vs. U.M. 31±42 (p < 0,001). Bei unangekündigten Mahlzeiten unterschied sich zudem die Zeit bis zum Glucosespitzenwert leicht zwischen kohlenhydratreichen und gemischten Mahlzeiten (91±27 vs. 81±24 min, p = 0,023). Für angekündigte Mahlzeiten zeigten die PID- und MPC-Algorithmen vergleichbare Ergebnisse bei rein kohlenhydratbasierten Mahlzeiten. Bei gemischten Mahlzeiten (A.M.) erzielte der PID-Algorithmus jedoch: niedrigere Glucosespitzen, eine reduzierte TAR und eine höhere TiTR. Bei unangekündigten Mahlzeiten (U.M.) zeigte sich ein deutlicher Vorteil des PID-Algorithmus: 2 h ΔBG (mg/dl): PID 56±36 vs. MPC 87±47 (p < 0,001), begleitet von niedrigeren Glucosespitzen, geringerem TAR und höherem TIR sowie keine signifikanten Unterschiede beim 4 h ΔBG oder bei der Zeit bis zur Spitze.
Fazit: Beide Systeme konnten postprandiale Glucoseschwankungen nach unangekündigten Mahlzeiten innerhalb von 4 Stunden ohne Sicherheitsprobleme wieder auf das präprandiale Niveau bringen. Der PID-Algorithmus zeigte dabei eine reaktivere Insulinantwort auf unangekündigte Mahlzeiten, während der MPC-Algorithmus (Control-IQ / t:slim X2) ähnlich effektiv war, wenn die Mahlzeiten angekündigt wurden. Diese Ergebnisse unterstreichen, dass algorithmische Unterschiede die Reaktionsdynamik bei realen Alltagssituationen beeinflussen – ein entscheidender Aspekt für die Weiterentwicklung zukünftiger AID-Systeme mit besserer Anpassungsfähigkeit an menschliches Verhalten.
Dieser Artikel erscheint als Teil des wöchentlichen Letters zu hochaktuellen Entwicklungen im Bereich Diabetes Technologie. Nutzen Sie das nebenstehende Formular um sich für den diatec weekly Newsletter anzumelden!
Mit freundlichen Grüßen
![]()

